Cochrane Corner: I corticosteroidi nel trattamento dei pazienti affetti da sepsi
giovedì, aprile 7th, 2016Dott. Paolo Balzaretti, redazione Blog SIMEU
Su Twitter: @P_Balzaretti
Conoscenze attuali
L’impiego di steroidi nella sepsi ha una lunga storia. Inizialmente furono proposti trattamenti con alte dosi per brevi periodi, la cui è efficacia è stata smentita da alcune revisioni alla metà degli anni’90 (1). Per questo motivo sono stati proposti regimi terapeutici a basati su dosi più basse, ma le evidenze a riguardo risultano tutt’ora contraddittorie con i due più importanti trial randomizzati che riportano conclusioni conflittuali (Annane 2002 e Sprung 2008).
Secondo le linee guida della Surviving Sepsis Campaing, i corticosteroidi non andrebbero impiegati nei pazienti con sepsi. Nel caso di pazienti con shock settico, la somministrazione andrebbe riservata a coloro i quali permangono ipotesi dopo adeguato riempimento volemico e introduzione di vasopressori. Qualora indicato, viene consigliato l’impiego di idrocortisone con dose massima giornaliera di 200 mg. Il trattamento andrebbe scalato quando non vi è più necessità di supporto aminico (2).
La revisione sistematica che andremo a vedere affronta nuovamente il tema, proponendosi di sintetizzare le evidenze fin qui pubblicate.
La Revisione Cochrane (3)
Titolo: Corticosteroids for treating sepsis.
Autori: Annane D, Bellissant E, Bollaert PE, Briegel J, Keh, Kupfer Y.
Citazione bibliografica: Cochrane Database Syst Rev 2015; 12: CD002243.
Link: http://www.ncbi.nlm.nih.gov/pubmed/2663326
Obiettivo: Esaminare gli effetti dei corticosteroidi sulla mortalità ad un mese e valutare se la dose e la durata del trattamento influenzano la risposta al trattamento.
Studi inclusi: trial randomizzati controllati, in cieco o meno.
Outcome primario: mortalità totale a 28 giorni
Outcome secondari: mortalità in Terapia Intensiva, mortalità intra-ospedaliera, regressione dello shock a 7 e 28 giorni, entità della disfunzione d’organo, durata della degenza in Terapia Intensiva, durata della degenza ospedaliera, eventi avversi.
N°. di studi inclusi: 33
N° di pazienti: 4268
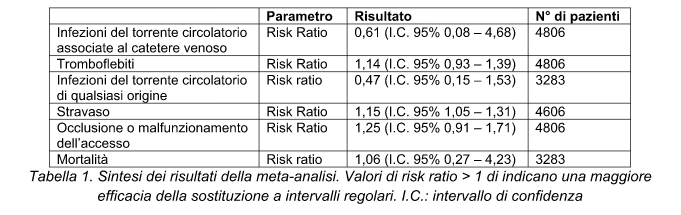
Risultati:
|
Parametro |
Risultato |
N° di pazienti |
|
|
Mortalità a 28 giorni |
|||
|
Corticosteroidi vs. controllo* |
Risk ratio |
0,87 (I.C. 95% 0,76 – 1,00) |
3176 |
|
Corticosteroidi (basse dosi, lunga durata) vs. controllo |
Risk ratio |
0,87 (I.C. 95% 0,78 – 0,97) |
2266 |
|
Corticosteroidi (alte dosi, breve durata) vs. controllo |
Risk ratio |
0,96 (I.C. 95% 0,80 – 1,16) |
910 |
|
Corticosteroidi vs. controllo (solo studi con doppio cieco adeguato) |
Risk ratio |
0,95 (I.C. 95% 0,84 – 1,08) |
2259 |
|
Corticosteroidi vs. controllo (solo pazienti con shock settico) |
Risk ratio |
0,88 (I.C. 95% 0,78 – 0,99) |
1444 |
|
Mortalità intra-ospedaliera |
|||
|
Corticosteroidi vs. controllo |
Risk ratio |
0,85 (I.C. 95% 0,73 – 0,98) |
2014 |
|
Corticosteroidi (basse dosi, lunga durata) vs. controllo |
Risk ratio |
0,91 (I.C. 95% 0,82 – 1,01) |
1708 |
|
Differenza del SOFA score a 7 giorni |
|||
|
Corticosteroidi vs. controllo |
Differenza delle medie |
-1,53 (I.C. 95% -2,04 – 1,03) |
1132 |
|
Eventi avversi |
|||
|
Sovrainfezioni |
Risk ratio |
1,02 (I.C. 95% 0,87 – 1,20) |
2567 |
|
Iperglicemia |
Risk ratio |
1,26 (I.C. 95% 1,16 – 1,37) |
2081 |
|
Emorragia digestiva |
Risk ratio |
1,24 (I.C. 95% 0,92 – 1,67) |
2382 |
Tabella 1. Riassunto dei principali risultati. * solo due studi non prevedevano placebo. Basse dosi sono definite come dosi inferiori a 400 mg al giorno di idrocortisone o dosaggi equivalenti; se la durata del trattamento è ≥ a 3 giorni è definita lunga.
Interpretazione – conclusioni
Anche questa revisione evidenzia come l’impiego di corticosteroidi abbia un’efficacia molto scarsa nel trattamento del paziente con sepsi, anche nel caso si impieghino basse dosi per periodi prolungati. Parte dell’efficacia registrata potrebbe essere legata puramente alle limitazioni metodologiche degli studi primari, come dimostrato dalle analisi per sottogruppi: qualora vengano presi in considerazione solo gli studi di migliore qualità, l’impatto sulla sopravvivenza a 28 giorni viene completamente vanificato.
Anche l’impiego nei soli pazienti con shock settico, suggerito dalla Surviving Sepsis Campaign, sembrerebbe avere un impatto modesto, ai limiti della significatività statistica. Tali effetti devono essere considerati alla luce di un aumento del rischio di iperglicemia pari al 26%.
Questi dati potrebbero essere in qualche modo in accordo con la visione proposta recentemente nelle nuove definizione di sepsi e shock settico proposte dalla Society for Critical Care Medicine e l’European Society for Intensive Care Medicine secondo cui l’elemento con il maggior impatto sulla sopravvivenza del paziente con infezione e sepsi non è l’entità della risposta infiammatoria (la cui riduzione è l’obiettivo del trattamento con corticosteroidi) ma l’insorgenza di disfunzione d’organo. A questo riguardo, comunque, l’impiego di steroidi sembrerebbe avere un effetto benefico, garantendo la riduzione del SOFA score di circa 1,5 punti: questo dato potrebbe portare a riconsiderarne le indicazioni nei pazienti a maggiore rischio.
Bibliografia
-
Lefering R, Neugebauer EAM. Steroid controversy in sepsis and septic shock: a meta-analysis. Crit Care Med 1995;23(7):1294–303. Link
-
Dellinger RP, et al. Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock: 2012. Crit Care Med 2013; 41:580–637. Link
-
Annane D, Bellissant E, Bollaert PE, Briegel J, Keh D, Kupfer Y. Corticosteroids for treating sepsis. Cochrane Database Syst Rev 2015; 12: CD002243. Link
-
Singer M, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016;315(8):801-810. Link